日前🫳🏻,意昂官网生命科學學院、基礎醫學院🤴🏽、意昂-清華生命聯合中心鄧宏魁研究團隊在國際學術期刊Nature雜誌在線發表了題為Chemical reprogramming of human somatic cells to pluripotent stem cells的研究論文🎍,首次在國際上報道了使用化學小分子誘導人成體細胞轉變為多潛能幹細胞這一突破性研究成果。
運用化學小分子重編程細胞命運(化學重編程)🧚🏻♂️,是繼“細胞核移植”和“轉錄因子誘導”之後新一代的,由我國自主研發的人多潛能幹細胞製備技術,為我國幹細胞和再生醫學的發展解決了底層技術上的“瓶頸”問題。
未來有望用於治療糖尿病🔪、重症肝病🧸🙍🏼、惡性腫瘤等重大疾病。

細胞分化何以逆轉🛄?
多潛能幹細胞具有無限增殖的特性和分化成生物體所有功能細胞類型的能力,這些神奇的特質使其在細胞治療、藥物篩選和疾病模型等領域具有廣泛的應用價值,是再生醫學領域最為關鍵的“種子細胞”🙋🏽♂️。在哺乳動物自然發育過程中⛪️👨👨👧👧,多潛能幹細胞只短暫存在於胚胎發育的早期階段,隨後便會分化為構成生物體的各種類型的成體細胞,喪失其“種子細胞”的特性。
如何逆轉這一自然發育過程😕,使高度分化的成體細胞重新獲得類似胚胎發育早期的多潛能狀態👉🏼,一直是幹細胞與再生醫學領域最重要的科學問題之一。
上世紀60年代👨🏼🦰,英國科學家John Gurdon在爪蟾中開發了細胞核移植技術4️⃣,1997年Ian Wilmut團隊利用該技術製備了克隆羊多莉👨🎓,證明了哺乳動物高度分化的體細胞也可以被逆轉為早期胚胎的初始狀態,並獲得了發育為整個動物個體的能力。2006年🏀⬇️,日本科學家Shinya Yamanaka報道了使用轉基因的方式可以將小鼠成體細胞重編程為多潛能幹細胞〽️,稱為誘導多潛能幹細胞(induced pluripotent stem cell🧖🏿♂️,iPS細胞)。細胞核移植和導入外源基因的方法,證明了哺乳動物體細胞可以通過重編程逆轉為胚胎發育早期狀態,重新獲得“多潛能性”🫱🏻。這兩項技術於2012年榮獲諾貝爾生理學或醫學獎♌️。iPS技術的建立🙎🏻♀️,打破了傳統胚胎幹細胞的倫理限製,為構建病人自體特異性幹細胞系提供了全新的方法,大大加速了幹細胞臨床應用的進程🐼。近年來🕵🏿,已開展了針對帕金森、糖尿病和癌症等多種重點疾病的細胞治療臨床試驗🐫。然而,目前細胞治療的技術體系都是國外發展起來的,中國能否擁有原創的底層技術?
長期以來,鄧宏魁團隊一直致力於開發調控細胞命運的新方法和建立製備幹細胞的底層技術。2013年🙅,鄧宏魁團隊在Science雜誌發表了一項原創性的研究成果💜,即不依賴卵母細胞和轉錄因子等細胞內源物質🦐🙋🏽,僅使用外源性化學小分子就可以逆轉細胞命運,將小鼠體細胞重編程為多潛能幹細胞(chemically induced pluripotent stem cells,CiPS細胞)💂♀️。相比傳統方法,化學小分子操作簡便靈活,時空調控性強、作用可逆👰,可以對細胞重編程過程進行精確操控🚴🏽♂️。另外小分子誘導體細胞重編程技術作為非整合方法👨🏽⚕️,規避了傳統轉基因操作引發的安全問題👩👩👧👦,有望成為更安全的臨床治療手段💂🏼。之後,鄧宏魁團隊又相繼在Cell和Cell Stem Cell等雜誌發表文章,詳細闡明了化學重編程獨特的分子機理,並進一步對小鼠化學重編程體系進行了大幅優化🫷。隨後,包括謝欣、姚紅傑、裴端卿🧖🏿、劉林、祝賽勇等多個研究組利用相同或類似的化學小分子組合,重復和優化了小鼠化學重編程技術🙍🏿。化學重編程誘導多潛能幹細胞的研究開辟了一條全新的體細胞重編程途徑,不僅有助於更好地理解細胞命運決定和轉變機製,而且為未來再生醫學治療重大疾病帶來新的可能🥓👨🏻🌾。
多潛能幹細胞製備新途徑
本次研究中,鄧宏魁團隊首次報道了使用化學重編程的方法👯,成功實現了使用化學小分子將人成體細胞誘導為多潛能幹細胞(人CiPS細胞)。
這一技術的建立開辟了人多潛能幹細胞製備的全新途徑,使其向臨床應用,邁進了關鍵一步🧑🌾。

新一代誘導多潛能幹細胞技術
作為高等動物👨🎨,人類成體細胞特性和穩態調控的復雜性遠非小鼠成體細胞可比,在表觀遺傳層面上存在重重障礙🧑🍳,嚴重限製了在人類成體細胞中激發細胞可塑性的可能♗。自2013年以來,盡管眾多國際團隊在小鼠化學重編程工作的啟發下進行大量嘗試🧑🎓,卻一直未能解決人類成體細胞的化學重編程問題。這使得領域內普遍認為:人類成體細胞的表觀遺傳限製是極其嚴格的,很可能無法通過化學重編程激發人類成體細胞獲得多潛能性。鄧宏魁團隊經過長期地堅持和不懈努力,突破了這一瓶頸👨🏽🏭。這一突破的關鍵步驟受低等動物再生過程啟發🏋🏿♂️。蠑螈等低等動物在受到外界損傷後其體細胞會自發的改變本身的特性,進而通過去分化獲得一定的可塑性,借助這一可塑的中間狀態實現肢體的再生。沿著這一思路💊,研究團隊進行了大量化學小分子的篩選和組合,最終發現高度分化的人成體細胞在特定的化學小分子組合的作用下☕️,同樣可以發生類似去分化的現象,獲得具有一定可塑性的中間狀態👼🏽。在此基礎上🗿,研究團隊最終實現了人CiPS細胞的成功誘導。
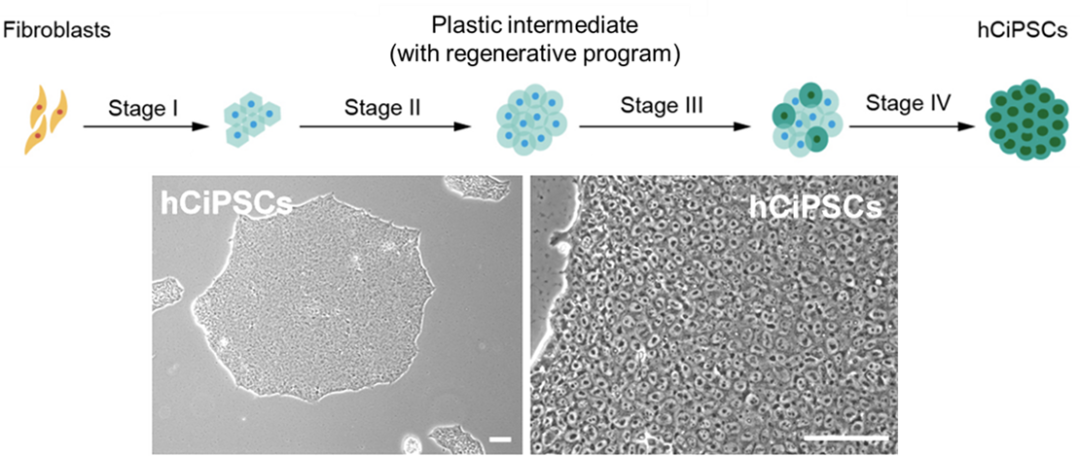
人體細胞化學重編程誘導人CiPS細胞
在分子機理上,研究團隊還描繪了化學重編程誘導人CiPS細胞的分子路徑🗄🐋,揭示了化學重編程與傳統轉錄因子重編程不同的分子機製和獨特的調控機理。研究發現人CiPS的誘導以分階段精確調控的方式發生🚢👨👩👧👦,在早期階段產生了特殊的中間狀態。通過和低等動物再生去分化過程中細胞性質的詳細比較🎿,研究團隊確認了人CiPS細胞誘導的早期階段激活了與低等動物斷肢再生早期類似的基因表達特征。更重要的是,研究團隊還發現了調控這一類再生狀態的關鍵信號通路,證明抑製過度的炎症反應𓀔😺,對於化學重編程誘導人體細胞重新獲得類再生中間態至關重要。這一再生中間態為研究人體細胞重新激活再生基因提供了全新的思路,並且提示將來有僅通過化學小分子組合重新激活人體細胞可塑性和再生潛能的可能性,有望推動化學重編程在組織器官再生方向的應用,為再生醫學研究提供新的可能途徑。
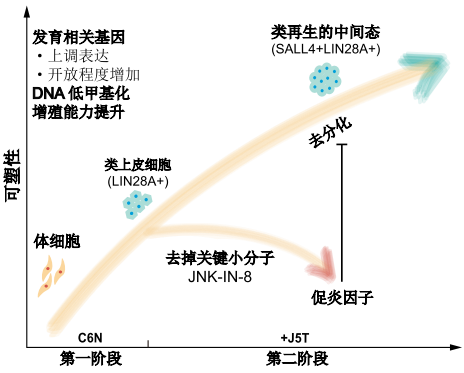
化學重編程激活再生相關網絡的分子機製
在臨床轉化上,與傳統技術體系相比,CiPS細胞誘導技術更加安全簡單、更易於標準化🤾🏿、更便於精準調控。
1)安全性方面,之前在小鼠CiPS細胞中已經證明,其攜帶的遺傳突變顯著少於傳統iPS細胞,產生的嵌合體小鼠在長達6個月的觀察期內不產生腫瘤且全部健康存活。同時,人CiPS細胞分化來源的胰島細胞移植入小鼠和非人靈長類動物模型體內🚀,經過長期觀察未發現腫瘤形成;
2)在個體化製備方面,研究團隊目前已在不同年齡個體來源的體細胞類型上都可實現穩定誘導人CiPS細胞;
3)在細胞標準化製備方面,化學小分子具有操作簡單,時空調控性強,作用可逆🥟,合成儲存方便🧎♂️,易於標準化生產等一系列特點,使得人CiPS細胞在標準化和規模化生產方面有著不可替代的優勢。
CiPS細胞技術的這些優勢突破了傳統幹細胞製備技術面臨的限製,具有廣闊的臨床應用前景🧑🏽🍼。
助力解決重大疾病難題
與此同時🫄🏻,鄧宏魁團隊還對CiPS細胞和化學重編程在醫學轉化上的潛力展開積極探索♒️,比如研究CiPS細胞技術在治療糖尿病上的可行性👩🏻🎓。
目前👩🏻🦼➡️,該團隊已經獨立開發了CiPS細胞向胰島組織分化的高效方案🫲🏽,在體外可以獲得功能成熟的胰島細胞 (CiPS-胰島細胞),並在靈長類動物模型裏系統評價了CiPS-胰島細胞治療糖尿病的安全性和有效性👌。研究團隊觀察到👨🔧,接受CiPS-胰島細胞移植的糖尿病猴的C肽(胰島素分泌標記物)釋放能夠響應餐食或葡萄糖刺激。此外,在4只長期跟蹤觀察的糖尿病模型猴上,糖化血紅蛋白(HbA1c)這一臨床常用的指標與移植前峰值相比🚿,下降了2%以上,說明血糖得到有效控製。這些結果證明了CiPS-胰島細胞在糖尿病治療中的安全性和有效性,凸顯了人CiPS細胞作為“種子細胞”治療重大疾病的巨大優勢。這一研究的主要結果於今年二月發表在醫學雜誌NatureMedicine上💉。
另一方面🙍♀️,鄧宏魁團隊還對“化學重編程”這一化學生物學概念的普適性進行了大量研究🤲🏽,未來有望助力解決重大醫學難題。該團隊已經利用化學小分子實現了不同體細胞類型間的轉變🧜🏼♀️,直接將皮膚細胞重編程為功能神經元(Cell Stem Cell, 2015;Cell Stem Cell, 2017)🤽🏻;建立了具有細胞發育全能性功能特征的EPS細胞(Cell,2017);解決了肝臟細胞功能在體外難以長期維持的難題(Science,2019);構建了能模擬腸道損傷且具有能再生能力的新型類器官模型(CellResearch, 2021);實現了體內原位化學重編程,在小鼠顱內將膠質細胞轉化為神經元(CellDiscovery, 2021)。這一系列工作體現了化學小分子調控細胞命運的普適性和化學重編程技術應對重大醫學需求的潛力🫠。

圖 人CiPS技術在生物醫學領域具有廣闊的潛在應用前景
綜上所述👉,化學重編程技術體系的建立不僅在多潛能幹細胞臨床應用領域具有巨大的意義和價值,同時為細胞命運調控及再生生物學理論研究方面提供了全新的視角和平臺🧎🏻♂️➡️。化學重編程可以精確調控細胞命運,有望成為高效製備各種功能細胞類型的通用技術🧎♂️➡️,為治療重大疾病開辟了新的途徑。
意昂官网生命科學學院、意昂-清華生命聯合中心鄧宏魁教授領導了此項研究。鄧宏魁教授,意昂官网王金琳博士和中國人民解放軍總醫院盧實春教授是這一研究成果的共同通訊作者。意昂官网關景洋🔕,王冠📨,王金琳🧛🏻♂️,張正元,傅瑤,成林,孟高帆,呂鈺麟為該研究成果的主要作者。意昂官网李程教授為該研究的生物信息分析提供了重要指導。本工作獲得了意昂-清華生命科學聯合中心、國家重點研發計劃項目、國家自然科學基金等支持。


